研究組織・メンバー
A03:ヒト型モデルマウスを用いた自閉症の神経回路の同定と治療への応用
 研究代表者
研究代表者
西山 正章
金沢大学医薬保健研究域医学系 組織細胞学・教授
WEBhttp://ana1.w3.kanazawa-u.ac.jp/
紹介文本文
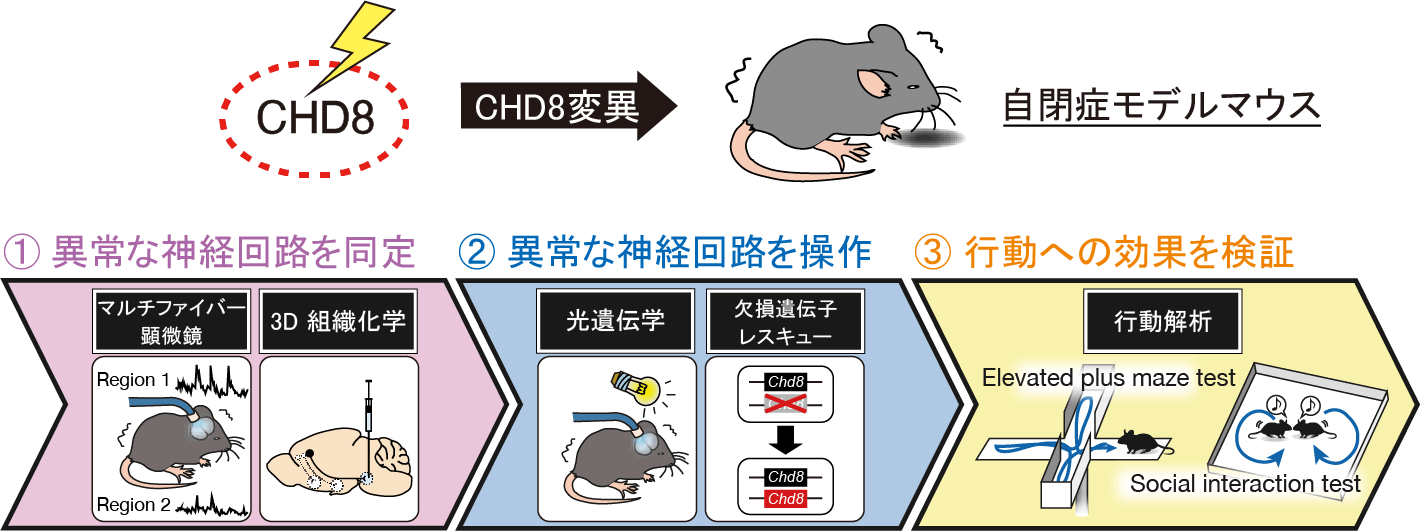
自閉スペクトラム症は、コミュニケーション能力の質的障害および常同・反復的な興味・行動で特徴付けられる非常に発症頻度の高い発達障害であり(全人口の約1.5%)、発症メカニズムの解明と治療法の開発が強く求められている。自閉症における脳情報動態を理解するためには、分子-細胞-回路-行動という多次元活動動態をリンクさせることが重要であり、ヒトの自閉症を再現したモデル動物の開発、脳における異常な回路の同定、異常な回路の操作による行動との関連性の検証が必要不可欠である。近年、自閉症患者の大規模なゲノム解析によってクロマチンリモデリング因子CHD8が最も有力な自閉症原因候補遺伝子として同定され、世界中で大きな反響を呼んでいる。申請者らは今までCHD8について長年にわたって研究をしてきたグループであり、これまでにCHD8がp53やβカテニンの転写活性を抑制することで発生期の器官形成に重要な役割を果たしていることを示してきた。申請者は最近、ヒト自閉症患者のCHD8変異を再現したモデルマウスを作製し行動解析を行ったところ、このマウスが自閉症様の行動異常を再現することを確認した。本研究では種々のCHD8機能喪失型マウス(ノックアウトマウス)とCHD8機能獲得型マウス(トランスジェニックマウス)を組み合わせることによって自閉症で異常が起こっている神経回路を同定すると共に、その異常が自閉症様行動と関連しているかどうかを検証し、疾患治療への応用を目指す。
文献
- Muto Y, Moroishi T, Ichihara K, Nishiyama M*, Shimizu H, Eguchi H, Moriya K, Koike K, Mimori K, Mori M, Katayama Y, Nakayama KI* (2019)
Disruption of FBXL5-mediated cellular iron homeostasis promotes liver carcinogenesis.
J Exp Med 216: 950-965.
(*Co-corresponding author) - Kita Y, Katayama Y, Shiraishi T, Oka T, Sato T, Suyama M, Ohkawa Y, Miyata K, Oike Y, Shirane M, Nishiyama M*, Nakayama KI* (2018)
The autism-related protein CHD8 cooperates with C/EBPβ to regulate adipogenesis.
Cell Rep 23: 1988-2000.
(*Co-corresponding author) - Muto Y, Nishiyama M*, Nita A, Moroishi T, Nakayama KI* (2017)
Essential role of FBXL5-mediated cellular iron homeostasis in maintenance of hematopoietic stem cells.
Nature Commun 8: 16114.
(*Co-corresponding author) - Katayama Y, Nishiyama M*, Shoji H, Ohkawa Y, Kawamura A, Sato T, Suyama M, Takumi T, Miyakawa T, Nakayama KI* (2016)
CHD8 haploinsufficiency results in autistic-like phenotypes in mice.
Nature 537: 675-679.
(*Co-corresponding author)


